
31/08/2021 no GenEra
Epiģenētika – Pārmaiņu zinātne
Parasti par ģenētiskiem traucējumiem un saslimšanām runā tad, ja mūsu DNS ir kādas gēnu izmaiņas. Tomēr mūsu gēnu uzvedība vai ekspresija jeb tas, kā tie darbojas, nav atkarīga tikai no pašas DNS secības - to ietekmē arī citi faktori, piemēram, mūsu ikdienas uzvedība un vide mums apkārt. Šie faktori tiek saukti par epiģenētiskajiem faktoriem, bet zinātne – epiģenētika – pēta, kā mūsu uzvedība un vide var ietekmēt gēnu darbību.
Epiģenētika ir pētniecības nozare par to, kā šūnas kontrolē gēnu aktivitāti, nemainot DNS sekvenci jeb secību. “Epi” grieķu valodā nozīmē virs vai augšā, ko var saprast arī kā uz, ja runa ir par genomu – uz genoma/virs genoma jeb virs DNS. Vārds “epiģenētisks” apraksta faktorus, kas sniedzas tālāk par ģenētisko kodu. Epiģenētiskās izmaiņas ir DNS modifikācijas, kas regulē, vai gēni ir “ieslēgti vai izslēgti”. Šīs modifikācijas ir ķīmiskas DNS modifikācijas, bet tās nemaina DNS secību. Visā DNS komplektā vienā šūnā, visas izmaiņas, kas regulē gēnu aktivitāti jeb ekspresiju, tiek sauktas par epigenomu.
Gandrīz gadsimtu pēc tam, kad termins "epiģenētika" pirmo reizi parādījās drukātā veidā, pētnieki, ārsti un citi veltījuši daudz laika, lai atrastu pavedienus, kas pierādītu, ka gēnu funkciju var mainīt ne tikai izmaiņas secībā. Mūsdienās daudzām slimībām, uzvedībai un citiem veselības rādītājiem jau ir atrasti pierādījumi, ka tie ir saistīti ar epiģenētiskiem mehāniskiem - vēzis, respiratorās saslimšanas, sirds un asinsvadu, reproduktīvās, autoimūnās un neiroloģiskās slimības. Epiģenētisko procesu izmaiņu izraisītāji var būt dažādi - smagie metāli, pesticīdi, dīzeļdegvielas izplūdes gāzes, tabakas dūmi, ogļūdeņraži, hormoni, radioaktivitāte, vīrusi, baktērijas un pamata uzturvielas. Epiģenētika stāsta par šūnu tādā veidā, ka, tikai skatoties uz gēnu ekspresijas līmeņiem (proteīnu ražošanas daudzuma), var noteikt, ka šūna ir citādāka. Piemēram, DNS metilēšanas profils veselās šūnās atšķiras no metilēšanas profila audzēja šūnās.
Pēdējo piecu, īpaši pēdējo divu gadu laikā vairāki revolucionāri pētījumi ir pievērsuši jaunu uzmanību epiģenētikai. Interese par šo nozari ir palielinājusies, jo kļuvis skaidrs, ka izpratne par epiģenētiku un epigenomiku (epiģenētisko izmaiņu izplatību visā genomā) ir nepieciešama darbā ar daudzām citām saistītajām tēmām, kurās nepieciešama izpratne par ģenētikas aspektiem, piemēram, cilmes šūnām, klonēšanu, novecošanu, sintētisko bioloģiju, sugu saglabāšanu, evolūciju un lauksaimniecību.
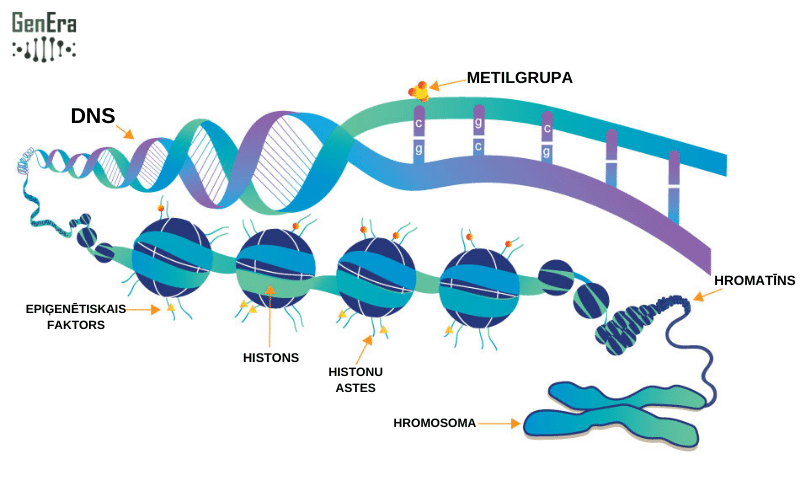
Epiģenētiskas izmaiņas maina gēnu izpausmes jeb ekspresijas apjomu. Tās palīdz noteikt, vai gēni tiek ieslēgti vai izslēgti, kas ietekmē proteīnu jeb olbaltumvielu ražošanas intensitāti šūnās. Katra šūna ražo tikai tos proteīnus, kas nepieciešami tās darbībai. Piemēram, olbaltumvielas, kas veicina kaulu augšanu, netiek ražotas muskuļu šūnās vai kur citur, kaut visās šūnās atrodas vienāds DNS komplekts ar visu gēnu DNS secībām. Epiģenētisko modifikāciju veidi katram organismam var atšķirties un būt dažādos audos un pat dažādās audu šūnās dažādi. Vides ietekme, piemēram personas diēta un piesārņotāju klātbūtne, var ietekmēt epigenomu. Šīs modifikācijas var saglabāties arī šūnu dalīšanās procesā, un dažos gadījumos, tās var tikt mantotas paaudzēs.
Epiģenētisko izmaiņu rašanās
Visbiežāk sastopamo epiģenētisko modifikāciju veidu sauc par DNS metilēšanu. DNS metilēšana ietver nelielu ķīmisku grupu, ko sauc par metilgrupu (tās sastāv no viena oglekļa atoma un trim ūdeņraža atomiem), pievienošanu DNS pamatelementiem. Kad metilgrupas ir gēnā, tad gēna ekspresija tiek apturēta - tas tiek "izslēgts" vai nomākts, un tas neražo olbaltumvielas. DNS metilēšana pirmo reizi tika pierādīta 1983. gadā, cilvēka audzējā (vēža šūnās), un kopš tā laika tiek novērota daudzās citās slimībās un veselības stāvokļos.
Otrs bieži izplatīts epiģenētisko izmaiņu veids ir hromatīna un histonu modifikācija. Histoni ir strukturāli proteīni šūnu kodolā. Hromatīns - proteīnu (histonu) un DNS komplekss, kas ir cieši saistīts, lai ietilptu kodolā. DNS apvijas ap histoniem, piešķirot hromosomām to formu. Histonus var modificēt, pievienojot vai noņemot ķīmiskās grupas, piemēram, metilgrupas vai acetilgrupas. Šīs grupas ietekmē to, cik cieši DNS ir satīts ap histoniem, kas ietekmē to, vai gēnu var ieslēgt vai izslēgt. Ja tiek mainīta hromatīna struktūra, tas ietekmē gēnu ekspresiju. Cieši savīts hromatīns mēdz izslēgt gēnu vai pat gēnu grupas, bet atvērtāks – gēna ekspresiju veicina.
Vēl ir arī citi epiģenētisko procesu veidi – RNS saistītā gēnu apslāpēšna (silencing), acetilēšana, fosforilēšana u.c.. Iespējams, vēlāk tiks atklāti vēl citi mehānismi. Epiģenētiskie procesi ir dabiski un nepieciešami daudzu organisma funkciju veikšanai, taču, ja tie notiek nepareizi, var notikt nopietna negatīva ietekme uz veselību un uzvedību.
Kļūdas epiģenētiskajā procesā, piemēram, nepareiza gēna modifikācija vai ķīmiskās grupas nepievienošana konkrētam gēnam vai histonam, var izraisīt patoloģisku gēnu aktivitāti vai inaktivitāti. Izmainīta gēnu aktivitāte, ieskaitot epiģenētiskās kļūdas, ir bieži sastopams ģenētisko traucējumu/slimību cēlonis.
Epiģenētiskā terapija un nākotnes vīzijas

Epiģenētika nākotnē var sniegt lielus sasniegumus un būtiskas izmaiņas veselības nozarē. Jau tagad, kopš šī pētniecības nozare ir attīstījusies, mēs daudz labāk saprotam dažādu faktoru ietekmi uz mūsu veselību un slimību attīstību.
Epiģenētiskā terapija pat nosaukta kā jaunais ierocis cīņā ar vēzi. Epiģenētiskā terapija cenšas atgriezt modifikācijas, izmantojot DNS metilēšanas (DNMT) inhibitorus (piemēram, azacitidīns, MG98) vai histonu deacetilāzes (HDAC) inhibitorus (piemēram, fenilsviestskābe, SAHA, depsipeptīds). Vairākos pētījumos ir pārbaudītas šīs terapijas, kas parādījušas potenciālu samazināt to slimību slogu, kurās patoloģiskiem epiģenētiskiem mehānismiem ir izšķiroša nozīme.
DNS metilēšanas procesā audzēja nomācošie gēni tiek hipermetilēti, kas izraisa to inaktivāciju, savukārt vīrusu onkogēnu hipometilēšana izraisa onkogēno vīrusu gēnu aktivizāciju. Ar šādu pašu procesu, mērķējot uz konkrētajām šūnām, var panākt pretēju efektu. DNS metilēšanas inhibitori kļuvuši par pamatu noteiktu hematoloģisku audzēju ārstēšanai. Tie pamatā darbojas, atkārtoti aktivizējot gēnus, tajā skaitā audzēja supresorus, kas metilēšanas procesā tikuši "izslēgti".
Lai gan epiģenētiskā ārstēšana ir ļoti daudzsološa, lai nākotnē to attīstītu un veidotu vēl precīzāku, svarīgi pētījumi ir ne tikai medikamentiem, bet arī pašiem epiģenētiskajiem faktoriem. Būtisks faktors ir tam, vai zinātnieki spēs vēl precīzāk noteikt epiģenētiskās modifikācijas, lai tām izstrādātu vēl precīzākas ārstēšanas pieejas.